La química es la ciencia que estudia la materia:
Mezclas Se separan con métodos físicos
Compuestos químicos Se separan por métodos químicos
Elementos
Analisis químico
Mezcla Agua Salada Agua y sal
H2O NaCl cloruro de sodio
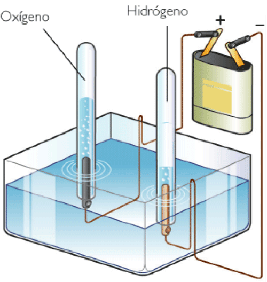
El agua se separa por electrolisis se obtiene H y O Na y Cl
La síntesis es la unión de dos o mas elementos para obtener nuevos compuestos
Por ejemplo:
Hidrogeno + oxigeno produce Agua
2 H + O H2O
Cloro + sodio produce Cloruro de sodio
Cl + Na Na Cl
Hidrogeno mas Cloro produce Acido clorhídrico
H + Cl HCl
Sodio mas oxigeno oxido de sodio
2Na + O Na2O
Hidrogeno mas oxigeno peróxido de sodio
2H + 2O H2O2
Hidrogeno mas sodio produce Hidruro de sodio
H + Na NaH
Oxigeno mas cloro anhídrido u oxido no metalico
O + Cl Cl2O Oxido de dicloro
3O + 2Cl Cl2O3 Trioxido de Dicloro
5O + 2Cl Cl2O5 Pentoxido de dicloro
7O + 2Cl Cl2O7 Heptoxido de dicloro
Tres elementos Na Cl O H
Na Cl O NaClO Hipoclorito de Sodio
Na Cl 3O NaClO3 Clorito de sodio
Na Cl 5O NaClO5 clorato de sodio
Na Cl 7º NaClO7 perclorato de sodio
H + Cl + O HClO Acido hipocloroso
H+ CL + 3O HCIO3 ACIDO CLOROSO
H CL 5O HCLO5 ACIDO CLORICO
H CL 7º HCLO7 ACIDO PERCLORICO
Na H O NaOH Hidroxido de sodio
Modelo esquematico del agua H2O
HIDROXIDO DE SODIO NaOH