El martes:
Vimos los óxidos metálicos y sus características y comprobamos con el experimento su conductividad eléctrica y su pH.
El jueves:
El jueves vimos los óxidos no metálicos que al combinarse con agua reaccionan formando oxiacidos hicimos una práctica para determinar su pH.
Quìmica I
108-B Viviana M. C. V.
Formulas

domingo, 21 de noviembre de 2010
Los óxidos de los no metales
Los no metales cuando se combinan con oxígeno, forman óxidos que también son llamados anhídridos. En general estos óxidos suelen estar en estado gaseoso ya que sus moléculas son bastante pequeñas y poco polares. Se desprenden de la actividad volcánica y de la actividad industrial del planeta y se incorporan a la atmósfera, causando problemas ambientales ya que incrementan el efecto invernadero y la lluvia ácida.
Recordemos que los elementos no metálicos son los que pertenecen al grupo del Boro (B), el del Carbono(C), Nitrógeno(N), el del Oxígeno(O) y los Halógenos que están encabezados por el Fluor (F)
¿Como actúan los no metales cuando se unen entre sí?
Por supuesto que se respeta la regla del octeto y la tendencia de los elementos a semejarse a los gases Nobles que le preceden, si son metales, o al gas noble siguiente del periodo en que se encuentran si se trata de los no metales.
Recordemos la Nota de Uniones Químicas formadoras de sustancias
“Cuando el Hidrógeno que tiene un sólo electrón (1) se encuentra con el oxígeno que tiene 8 electrones (2_6), este último necesita dos electrones para semejarse al Neón (2_8) pero al hidrógeno no le interesa perder su electrón pues de este modo no se parecería a ninguno de los nobles, en realidad, necesita un electrón para parecerse al Helio (2) por lo tanto el problema se soluciona fácilmente: Se asocian 2 (dos) hidrógenos con un oxígeno y comparten sus electrones, de este modo cada uno de ellos se mantiene en la sustancia como si fueran gases nobles ¿Cuál es esa sustancia? Simplemente el agua (dos hidrógenos y un oxígeno). Este tipo de unión donde los electrones se comparten se llama unión covalente y se da en las sustancias donde los átomos que se combinan son no metales.”
Cloro (Cl)
Este átomo tiene 17 electrones en total dispuestos 2-8-7 de modo que como en su último nivel posee 7 (siete) electrones con sólo compartir uno completará su octeto y se asemejará al Argón. Formará cuatro óxidos estables donde actuará con 1, 3,5 y 7 electrones así que la nomenclatura tradicional los distinguirá con los prefijos
Hipo----oso cuando actúa con 1 electrón
Oso cuando actúa con 3 electrones
Ico cuando actúa con 5 electrones
Per------ico cuando actúa con los 7 electrones
Formará
Cl2O
Tradicionalmente: óxido hipocloroso
Modernamente: monóxido de di cloro
Nomenclatura stock: oxido de Cloro (I)
Aquí cada Cloro le aporta un electrón al oxígeno completando el octeto del mismo y quedando completo su propio octeto ya que sólo necesita un sólo electrón.
Como a cada uno de los Cloros le sobran 3(tres) pares de electrones se formarán el resto de los óxidos con uniones covalentes dativas formándose
Cl2O3
Tradicionalmente: óxido cloroso
Modernamente: trióxido de dicloro
Numeral stock: Óxido de Cloro (III)
Dos de los oxígenos con unión covalente dativa.
Cl2O5
Tradicionalmente: óxido Clorico
Modernamente: pentóxido de dicloro
Numeral stock: Óxido de Cloro (V)
Cuatro de los oxígenos con unión covalente dativa.
Cl2O7
Tradicionalmente: óxido perclórico
Modernamente: heptóxido de di Cloro
Numeral stock: Óxido de Cloro (VII)
http://hablemosdeciencia.blogspot.com/2009/04/oxidos-no-metalicos-cf-n-109.html
Recordemos que los elementos no metálicos son los que pertenecen al grupo del Boro (B), el del Carbono(C), Nitrógeno(N), el del Oxígeno(O) y los Halógenos que están encabezados por el Fluor (F)
¿Como actúan los no metales cuando se unen entre sí?
Por supuesto que se respeta la regla del octeto y la tendencia de los elementos a semejarse a los gases Nobles que le preceden, si son metales, o al gas noble siguiente del periodo en que se encuentran si se trata de los no metales.
Recordemos la Nota de Uniones Químicas formadoras de sustancias
“Cuando el Hidrógeno que tiene un sólo electrón (1) se encuentra con el oxígeno que tiene 8 electrones (2_6), este último necesita dos electrones para semejarse al Neón (2_8) pero al hidrógeno no le interesa perder su electrón pues de este modo no se parecería a ninguno de los nobles, en realidad, necesita un electrón para parecerse al Helio (2) por lo tanto el problema se soluciona fácilmente: Se asocian 2 (dos) hidrógenos con un oxígeno y comparten sus electrones, de este modo cada uno de ellos se mantiene en la sustancia como si fueran gases nobles ¿Cuál es esa sustancia? Simplemente el agua (dos hidrógenos y un oxígeno). Este tipo de unión donde los electrones se comparten se llama unión covalente y se da en las sustancias donde los átomos que se combinan son no metales.”
Cloro (Cl)
Este átomo tiene 17 electrones en total dispuestos 2-8-7 de modo que como en su último nivel posee 7 (siete) electrones con sólo compartir uno completará su octeto y se asemejará al Argón. Formará cuatro óxidos estables donde actuará con 1, 3,5 y 7 electrones así que la nomenclatura tradicional los distinguirá con los prefijos
Hipo----oso cuando actúa con 1 electrón
Oso cuando actúa con 3 electrones
Ico cuando actúa con 5 electrones
Per------ico cuando actúa con los 7 electrones
Formará
Cl2O
Tradicionalmente: óxido hipocloroso
Modernamente: monóxido de di cloro
Nomenclatura stock: oxido de Cloro (I)
Aquí cada Cloro le aporta un electrón al oxígeno completando el octeto del mismo y quedando completo su propio octeto ya que sólo necesita un sólo electrón.
Como a cada uno de los Cloros le sobran 3(tres) pares de electrones se formarán el resto de los óxidos con uniones covalentes dativas formándose
Cl2O3
Tradicionalmente: óxido cloroso
Modernamente: trióxido de dicloro
Numeral stock: Óxido de Cloro (III)
Dos de los oxígenos con unión covalente dativa.
Cl2O5
Tradicionalmente: óxido Clorico
Modernamente: pentóxido de dicloro
Numeral stock: Óxido de Cloro (V)
Cuatro de los oxígenos con unión covalente dativa.
Cl2O7
Tradicionalmente: óxido perclórico
Modernamente: heptóxido de di Cloro
Numeral stock: Óxido de Cloro (VII)
http://hablemosdeciencia.blogspot.com/2009/04/oxidos-no-metalicos-cf-n-109.html
Óxidos no metálicos
a.- ¿Cómo se forman los óxidos no metálicos?
Características de los oxidos no-metálicos
Material:
Procedimiento:
- Colocar una muestra del no-metal (solido) en la cucharilla de combustión.
- Colocar la cucharilla de combustión dos minutos a la flama del mechero e introducir la cucharilla de combustión en 10 mililitros de agua destilada con cinco gotas del indicador universal dentro de la capsula de porcelana.
- Determinar el pH de la sustancia obtenida en la capsula de porcelana.
- Colocar 10 ml de agua destilada en la capsula de porcelana, adicionar cinco gotas del indicador universal, agregar cinco gotas del acido nitrico y anotar los cambios observados.
- OBSERVACIONES:



B.- ¿Qué productos se forman al reaccionar el oxido no metálico con el agua?
Equipo | Respuesta A | Respuesta B |
1 | Por un oxigeno y un no metal | Se forma un oxácido :s |
2 | Por un oxigeno y un no metal. J J J J :D :D :D | Se forma un oxácido J : D |
3 | Con un oxigeno y un no metal ☻♥☺ | Se forman oxácidos ♠ |
4 | Al combinar oxígeno más un no metal <3 | Se forma un oxácido ;) |
5 | Al unir el Oxigeno con un no metal (: | Se forma un OxiiaciidO :D |
6 | Se forman al reaccionar un no metal con el oxígeno | Un oxácido <3 C= |
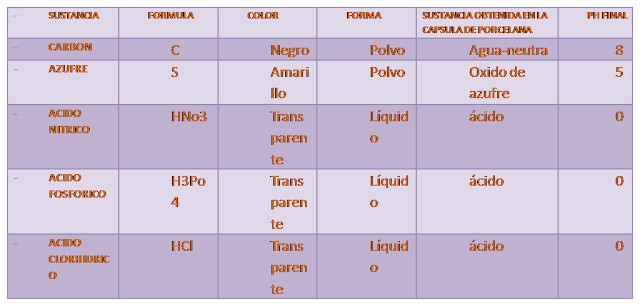
Características de los oxidos no-metálicos
Material:
Capsula de porcelana,
- agitador de vidrio,
- lámpara de alcohol,
- cucharilla de combustión,
- probador de conductividad eléctrica.
Sustancias.
- Carbón en polvo,
- azufre, acido ni rico,
- acido fosfórico,
- acido clorhídrico
- , indicador universal,
- tiras indicadoras de pH
- , agua destilada.
- Colocar una muestra del no-metal (solido) en la cucharilla de combustión.
- Colocar la cucharilla de combustión dos minutos a la flama del mechero e introducir la cucharilla de combustión en 10 mililitros de agua destilada con cinco gotas del indicador universal dentro de la capsula de porcelana.
- Determinar el pH de la sustancia obtenida en la capsula de porcelana.
- Colocar 10 ml de agua destilada en la capsula de porcelana, adicionar cinco gotas del indicador universal, agregar cinco gotas del acido nitrico y anotar los cambios observados.
- OBSERVACIONES:



Suscribirse a:
Comentarios (Atom)