Resumen martes y jueves
Lectura del resumen
Aclaración de dudas
Ejercicio
Registro de asistencia.
Martes: Vimos las propiedades periódicas de los elementos buscando cada equipo una y enseguida se hizo una actividad sobre el nitrógeno.
Jueves: Primero cada equipo representó los electrones de valencia de algunos elementos, después se hizo una actividad sobre la conductividad eléctrica y se determinó su enlace químico.
Formulas

sábado, 13 de noviembre de 2010
¿Qué son y cómo se representan los electrones de valencia?
¿Que son y como se representan los electrones de valencia?
Son los electrones que se encuentran en los mayores niveles de energía del átomo, siendo éstos los responsables de la interacción entre átomos de distintas especies o entre los átomos de una misma.
Estructura de Lewis
La estructura de Lewis, o puede ser llamada diagrama de punto, modelo de Lewis o representación de Lewis, es una representación gráfica que muestra los enlaces entre los átomos de una molécula y los pares de electrones solitarios que
Enlaces Químicos
Determinacion del tipo de enlace químico:
Material:
Sustancias:
Procedimiento:
a.- Colocar en la capsula de porcelana una muestra del cloruro de sodio, probar su conductividad eléctrica, agregar unas gotas de agua y probar nuevamente su conductividad eléctrica.Anotar las observaciones.
b.- Repetir el paso a con las demás sustancias.
Observaciones:
Conclusiones:
Algunos compuestos conducen la corriente eléctrica (enlace iónico y metálico) y otros no (enlace covalente).
Son los electrones que se encuentran en los mayores niveles de energía del átomo, siendo éstos los responsables de la interacción entre átomos de distintas especies o entre los átomos de una misma.
Estructura de Lewis
La estructura de Lewis, o puede ser llamada diagrama de punto, modelo de Lewis o representación de Lewis, es una representación gráfica que muestra los enlaces entre los átomos de una molécula y los pares de electrones solitarios que
Por equipo representar los electrones de valencia del grupo correspondiente:
Equipo | Grupo y Familia | Elementos y su Representacion de lewis |
1 | I Alcalinos | H*, Li*, Na*, K*, Rb*, Cs*, Fr*. |
2 | II Alcalinos Térreos | Be**, Mg**, Ca**, Sr**, Ba**, Ra**. |
3 | III Familia del Boro | B+++, Al+++, Ga+++, In+++, Ti+++, Tf+++. |
4 | IV Familia de los Carbonoideos | :C:, :Si:, :Ge:, :Sn:, :Pb: |
5 | V Familia del nitrógeno | * * * * * * *N* ,* P * , *As*, *Sb* , *Bi*, *Me* ** ** ** ** ** ** |
6 | VI Familia del oxígeno | ** ** ** ** ** *O* , * S * , *Se*, *Te* , *Po* ** ** ** ** ** |
7 | VII Halogenos | F, Cl, Br, I 7e. |
8 | VIII Gases nobles | He, Ne, Ar, Kr, Rn 8e. |
Enlaces Químicos
Enlace iónico Este enlace se produce cuando átomos de elementos metálicos (especialmente los situados más a la izquierda en la tabla periódica -períodos 1, 2 y 3) se encuentran con átomos no metálicos (los elementos situados a la derecha en la tabla periódica -especialmente los períodos 16 y 17). |
Enlace covalente |
Los enlaces covalentes son las fuerzas que mantienen unidos entre sí los átomos no metálicos (los Para explicar las propiedades características de los metales (su alta conductividad eléctrica y térmica, ductilidad y maleabilidad, ...) se ha elaborado un modelo de enlace metálico conocido como modelo de la nube o del mar de electrones: |
Enlace metálico Los átomos de los metales tienen pocos electrones en su última capa, por lo general 1, 2 ó 3. Éstos átomos pierden fácilmente esos electrones (electrones de valencia) y se convierten en iones positivos, por ejemplo Na+, Cu2+, Mg2+.elementos situados a la derecha en la tabla periódica -C, O, F, Cl, ...). |
Determinacion del tipo de enlace químico:
Material:
- Probador de conductividad eléctrica,
- capsula de porcelana.
Sustancias:
- Cloruro de sodio,
- sacarosa,
- metales,
- agua,
- alcohol.
Procedimiento:
a.- Colocar en la capsula de porcelana una muestra del cloruro de sodio, probar su conductividad eléctrica, agregar unas gotas de agua y probar nuevamente su conductividad eléctrica.Anotar las observaciones.
b.- Repetir el paso a con las demás sustancias.
Observaciones:
Sustancia | Conductividad en seco | Conductividad en húmedo | Tipo de enlace químico |
Cloruro de sodio | no | si | iónico |
Sacarosa | no | no | covalente |
Metal | Si | si | Metálico |
Alcohol | --------- | no | Covalente |
Agua | no | Covalente |
Conclusiones:
Algunos compuestos conducen la corriente eléctrica (enlace iónico y metálico) y otros no (enlace covalente).
Semana 14- ¿Cuales son las propiedades periódicas de los elementos?
- Estructura electrónica: distribución de los electrones en los orbitales del átomo |
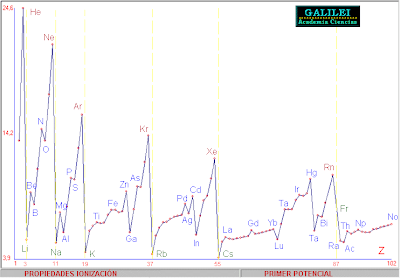
- Potencial de ionización: energía necesaria para arrancarle un electrón. |
- Electronegatividad: mide la tendencia para atraer electrones. |
- Afinidad electrónica: energía liberada al captar un electrón. |
- Carácter metálico: define su comportamiento metálico o no metálico. |
- Valencia iónica: número de electrones que necesita ganar o perder para el octete |
Equipo | Propiedades periódicas de los elementos químicos |
1 | Masa atómica y numero atómico: La masa atómica (ma) es la masa de un átomo, más frecuentemente expresada en unidades de masa atómica unificada.[1] La masa atómica puede ser considerada como la masa total de protones y neutrones en un solo átomo |
2 | |
3 | Potencial de ionización : energía necesaria para arrancarle un electrón |
4 | - Estructura electrónica: distribución de los electrones en los orbitales del átomo |
5 | Electronegatividad: La electronegatividad es una medida de la fuerza de atracción que ejerce un átomo sobre los electrones de otro en un enlace covalente |
6 | Valencia iónica numero de electrones que necesita ganar o perder para el octeto. |
Actividad experimental
El Nitrogeno
Suscribirse a:
Comentarios (Atom)